
吉西他濱聯(lián)合順鉑是晚期轉移性或不可手術切除膽道系統(tǒng)腫瘤(BTC)的標準一線治療,然而該方案的療效有限。目前PD-1 / PD-L1免疫檢查點抑制劑已經在多種腫瘤中取得了顯著療效,但是,在BTC中抗PD-1 / PD-L1抗體的研究還很有限。
為此,中國人民解放軍總醫(yī)院生物治療科韓為東教授團隊開展了納武利尤單抗(nivolumab)聯(lián)合吉西他濱和順鉑治療晚期BTC的臨床試驗,最新研究成果于2020年6月3日發(fā)表于Journal for ImmunoTherapy of Cancer (JITC,IF=8.728) 雜志。裕策生物參與其中的基因檢測與數(shù)據(jù)挖掘工作。
研究設計
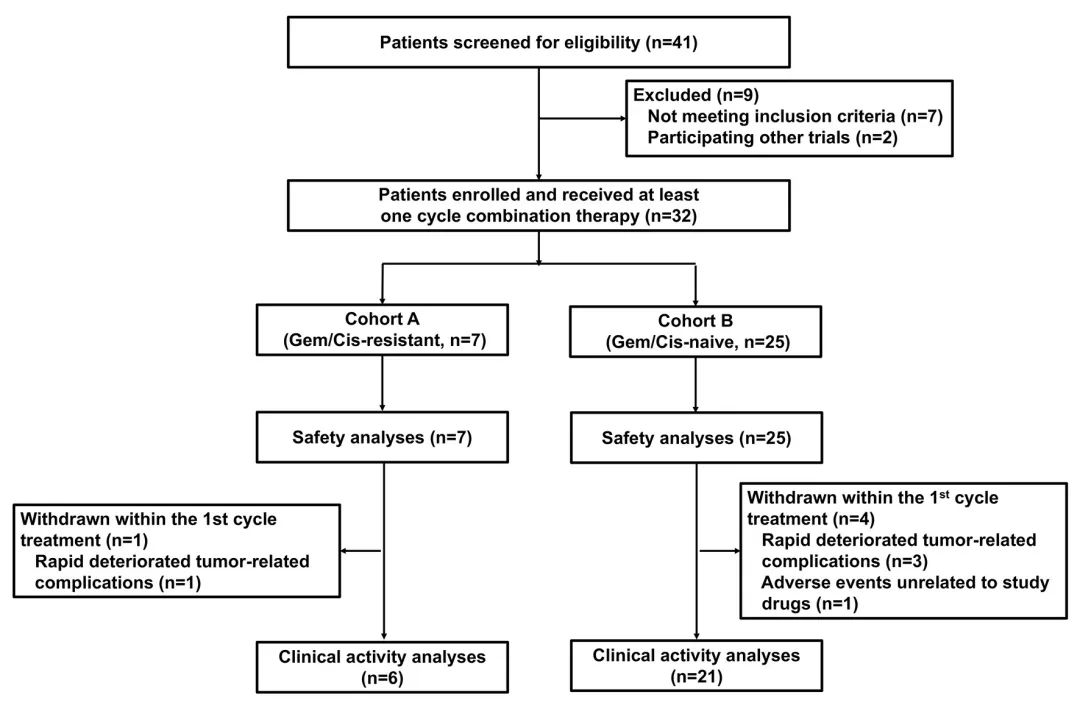
該研究是一項單中心、單臂、開放標簽的Ⅱ期臨床試驗, 旨在明確納武利尤單抗(nivolumab)聯(lián)合化療在晚期BTC中的療效和安全性。試驗共納入32位(中位年齡為60歲)的不可切除或轉移性BTC患者(ECOG評分為0-2)。
隊列劃分:根據(jù)先前的系統(tǒng)療法劃分為兩個隊列:隊列A(既往化療抵抗)和隊列B(未接受過化療)。
主要研究終點:客觀緩解率(ORR)。次要結果包括安全、疾病控制率(DCR)、無進展生存期(PFS)和總體生存期(OS)。
探索性目的:探索生物標志物,以預測臨床反應和預后。
治療方案
所有入組患者均接受聯(lián)合治療:吉西他濱1000 mg / m2(第1天和第5天),順鉑75 mg/m2(第1天)和nivolumab 3 mg/kg(第3天),靜脈輸注,3周一個療程,最多給予6個療程治療。此后,對反應敏感或疾病穩(wěn)定的患者改用維持治療,每6-8周給予一次nivolumab和吉西他濱治療。每次注射藥物之前,收集外周血樣品,以測試細胞因子的濃度水平。

療效結果
01 治療療效
在整個患者群體中,ORR為55.6%,DCR為92.6%。隊列A的7例患者中有6例可評估療效, 其中1例獲得CR,1例獲得PR ,ORR和DCR分別為33.3%和83.3%。在25例隊列B患者中,共21例患者納入療效評價,其中13例(61.9%)達到CR或PR,ORR和DCR分別達到61.9%和95.2%。

02 PFS和OS
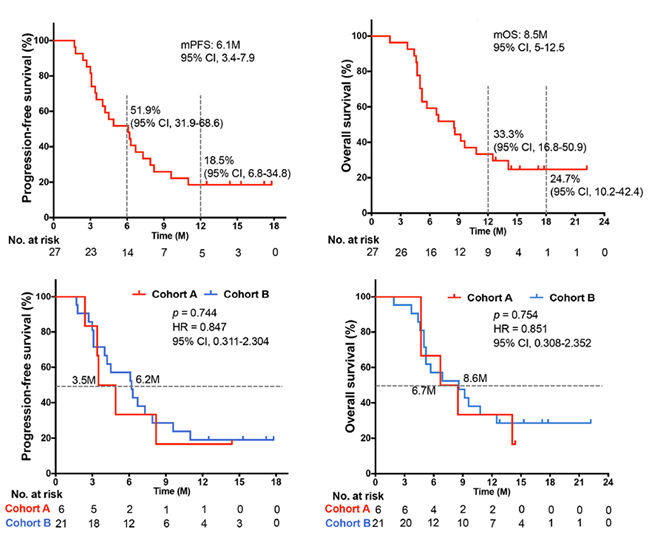
該研究的中位PFS為6.1個月(95%CI,3.4 - 8.2),6個月和12個月無進展的比例分別為51.9%(95%CI,31.9 - 68.6)和18.5%(95%CI,6.8 - 34.8)。中位OS為8.5個月(95%CI,5.0 - 12.5),12個月OS率和18個月OS率為33.3%(95%CI,16.8 - 50.9)和24.7%(95%CI,10.2 - 42.4)。
隊列A和隊列B的比較顯示,相較于化療進展患者,未接受過化療的患者可獲得更長的中位PFS,但兩者之間未顯示出顯著統(tǒng)計學差異。
03 與治療有關的毒性
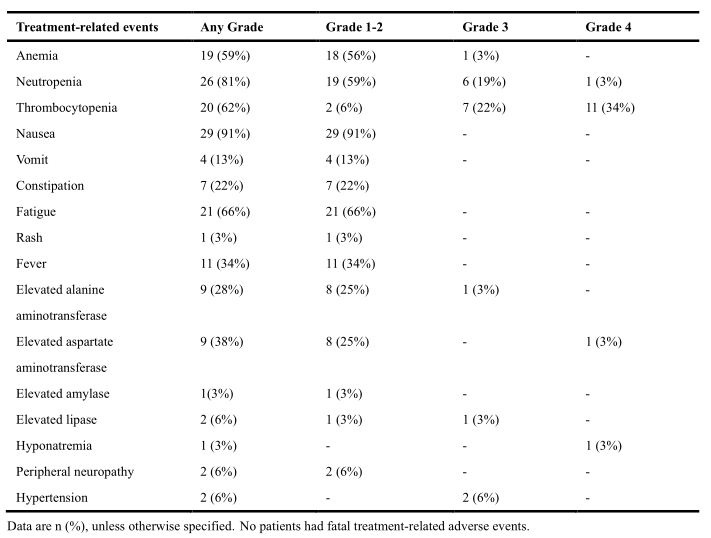
在32名入組患者中,所有患者均經歷了至少一項與治療相關的不良事件。最常見的不良事件為惡心(91%),中性粒細胞減少癥(81%),疲勞(66%),血小板減少(62%)和貧血(59%)。最常見的3級以上治療相關不良反應為血小板減少 (56%),中性粒細胞減少癥(22%)。其他嚴重不良事件還包括3級丙氨酸轉氨酶升高(3%),4級天門冬氨酸轉氨酶升高(3%),3級脂肪酶升高(3%),3級低鈉血癥(3%)和3級高血壓(6%)。一名患者出現(xiàn)免疫治療相關不良事件:皮疹(3%)。治療過程中未出現(xiàn)與治療相關性死亡。
Biomarker探索
26個(81%)腫瘤樣本進行了PD-L1表達評估,其中12個(37%)的PD-L1表達陽性,14個(44%)陰性。PD-L1表達水平與療效反應、PFS、OS等均未顯示出明確的相關性。
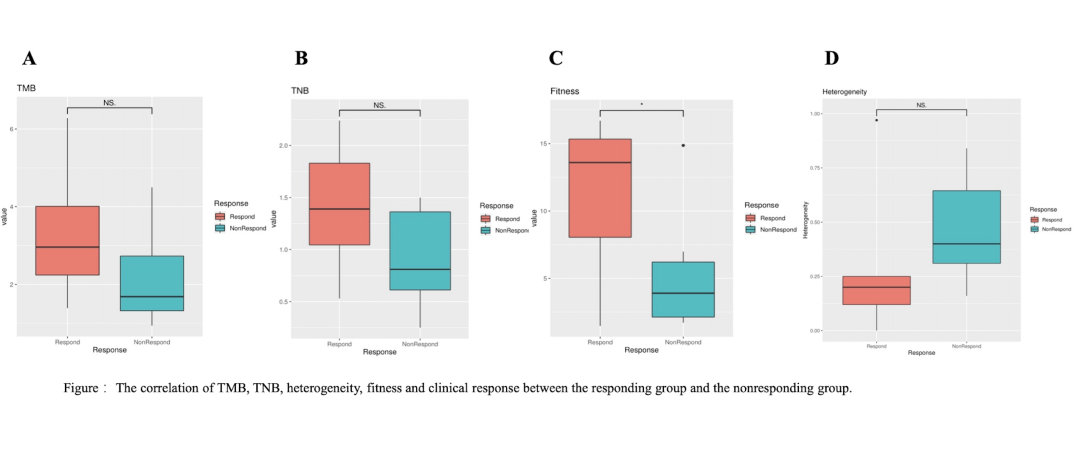
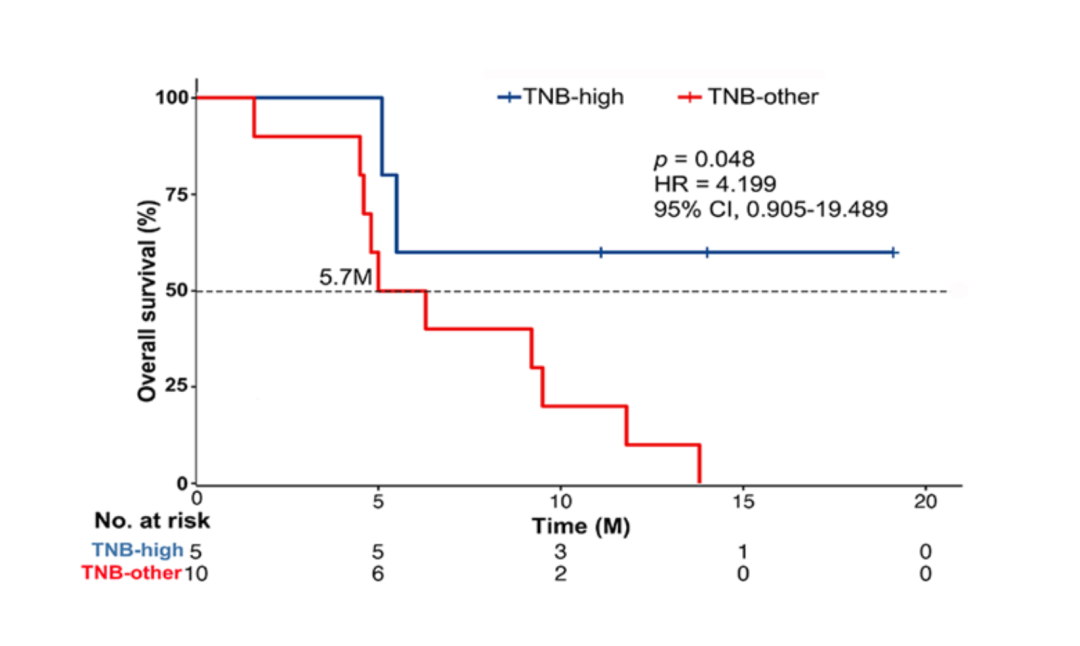
研究表明,應答組(CR+PR)中腫瘤突變負荷(TMB),新生抗原負荷(TNB)和腫瘤適合性模型評分(fitness score)均高于非應答組(SD+PD),而腫瘤異質性(intra-tumor heterogeneity)在應答組中較低,在這些指標中fitness score具有統(tǒng)計差異(p = 0.041)。另外TNB (cutoff = 1.37 neo/ Mb)具有預后價值,TNB > 1.37的患者的OS明顯長于TNB<1.37的患者(p = 0.048)。
對治療過程中外周血T細胞變化的分析表明,應答組中基線血液的CD3 +T細胞的基線比例高于非應答組中的比例(p = 0.046)。聯(lián)合治療開始后,患者外周血中HLA-DR+CD3+T細胞的比例增加,特別是在客觀反應患者中(p = 0.009),但在應答者和非應答者之間未觀察到統(tǒng)計學差異。

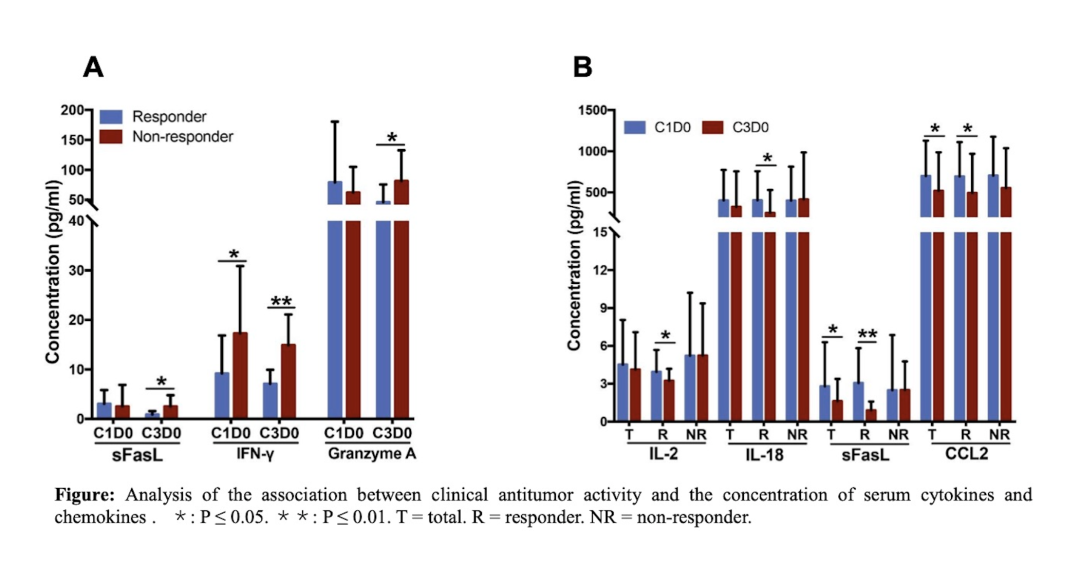
此外研究者還進行了基線(C1D0)和兩療程后(C3D0)外周血清細胞因子和趨化因子的變化與臨床響應之間的關聯(lián)性分析。聯(lián)合治療2個周期后,非應答組血清sFasL和顆粒酶A的濃度均高于應答組(p = 0.042和0.048),而應答組中的IL-2、IL-18、sFasL和CCL2的濃度與非應答組相比顯著下降(P = 0.036、0.047、0.012和0.042)。
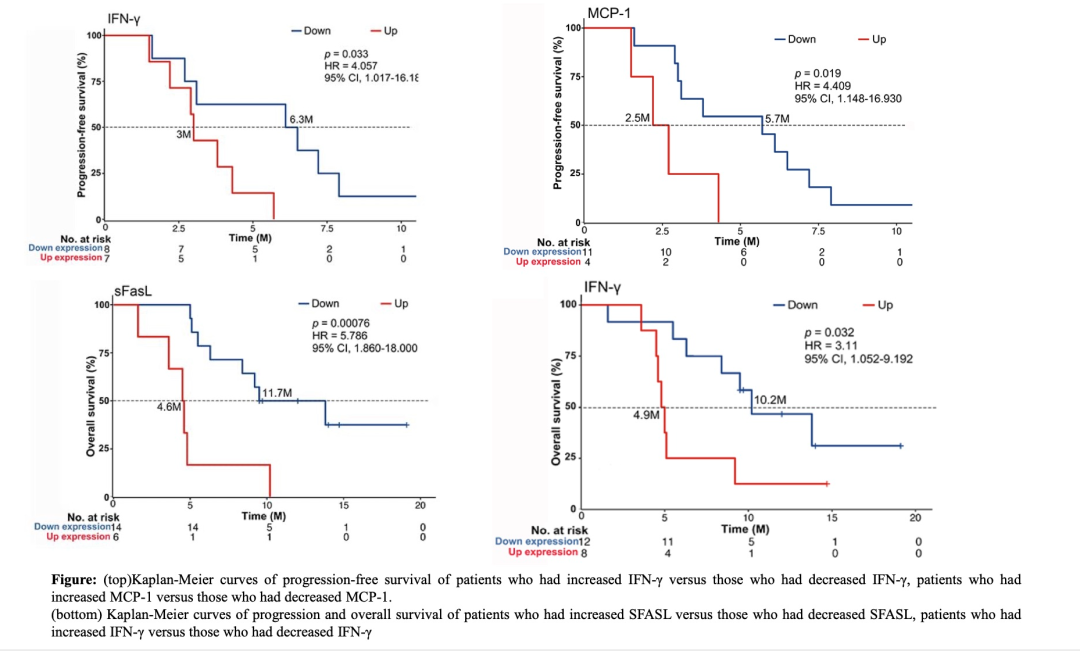
進一步分析發(fā)現(xiàn),聯(lián)合治療后IFN-γ和MCP-1濃度降低的患者比治療后濃度升高或保持相同水平的患者可獲得更長的PFS(p = 0.033和p = 0.019);治療后血清sFASL和IFN-γ水平下降患者中可獲得更長的OS(分別為p = 0.00076和 0.032)。
總結
本研究表明nivolumab聯(lián)合吉西他濱和順鉑在晚期不可切除或轉移性BTC中具有良好的抗腫瘤療效和可控的安全性,但相較于化療,臨床預后數(shù)據(jù)未顯示出顯著提高。而biomarker的探索研究發(fā)現(xiàn):
1.較高的TMB和TNB和較低的腫瘤異質性可能會有更好的臨床反應;
2.發(fā)現(xiàn)基線血液中較高的基線CD3+T細胞比例和治療過程中外周血IL-2、IL-18、sFasL和CCL2水平的降低可能預示基于ICI的聯(lián)合治療的更好結果;
3.治療前TNB較高的患者可獲得更長的OS。受樣本量與非隨機設計的限制,這項初步研究的結果尚需后續(xù)更大樣本量的隨機對照臨床試驗確認。
專家點評
01韓為東主任
膽管癌是目前腫瘤治療領域的臨床難題之一,尤其是對于不可手術切除或復發(fā)轉移患者,長期以來沒有很突出的治療方案。本團隊近年來針對這類患者進行了一些前瞻性探索性臨床研究。
我們之前的結果顯示,相較于傳統(tǒng)治療手段,CAR T細胞治療的臨床療效方面有所提高,主要結果發(fā)表于Clinical Cancer Research與Protein & Cell雜志。本次發(fā)表的是關于化療聯(lián)合免疫療法治療膽管癌的II期臨床試驗結果,盡管是單臂研究,但獲得了比較樂觀的結果,初步證實了聯(lián)合PD1抗體對于客觀緩解率與生存率的提升。
綜合看,本團隊的幾項研究基本上可以說明免疫治療在膽管癌的治療中具有進一步發(fā)展的空間。回到本研究,由于患者對免疫治療響應的差異性,我們也試圖尋找可以有效預測療效的分子特征與標記,文中可以看到除了血清學分子與療效關聯(lián)外,腫瘤本身的生物學分子特征與免疫治療之間的關聯(lián)性值得進一步完善數(shù)據(jù)挖掘。
02趙海濤主任
近期中國人民解放軍總醫(yī)院第一醫(yī)療中心韓為東教授團隊在J Immunother Cancer上發(fā)表的使用免疫檢查點抑制劑納武利尤單抗(Nivolumab)聯(lián)合吉西他濱和順鉑化療在不能切除或轉移性膽管癌(BTC)的有效性和生物標志物的2期臨床研究。本研究共入組32名患者,多數(shù)病人存在肝轉移,分為化療進展組(cohort A)及化療初治組(cohort B)。
本研究的主要終點是客觀應答率(ORR),總的而言,ORR能達到55.6%,且在化療初治組療效更好,疾病控制率為92.6%,這在晚期膽管癌中是難能可貴的。其他指標結果:中位無疾病進展生存(PFS)和總生存(OS)為6.1個月和8.5個月。最常見的3級或以上不良事件還是和化療相關,如血小板減少(56%)和中性粒細胞減少(22%)等。
本研究和日本學者在Lancet Gastroenterol Hepatol[1]報道結果類似。更重要的是,該研究探索了療效的生物標志物,通過對腫瘤樣本進行了全外顯子測序(WES),PD-L1表達的檢測及外周血的細胞因子的檢測。發(fā)現(xiàn)新抗原適應度(Fitness)可能是預測臨床應答的生物標志物。治療前新生抗原負荷(TNB)高和治療前后血清可溶性FasL、MCP-1、IFN-γ的變化與預后相關。為患者人群分層管理及后期的更大規(guī)模的臨床試驗提供了依據(jù),期待基于此研究的更大規(guī)模的臨床研究進行造福晚期膽管癌患者。
點評專家介紹

韓為東
解放軍總醫(yī)院生物治療科主任、教授
臨床腫瘤學博士研究生導師
國家百千萬人才
首都科技創(chuàng)新領軍人才
原總后勤部科技新星
重點研究方向
主要從事腫瘤治療抵抗機制與腫瘤免疫治療的臨床研究。先后承擔科技部重大專項1項,973課題2項、863項目3項、國家自然基金重大項目1項,重點項目2項,面上項目7項,北京市生物技術前沿項目1項,獲得企業(yè)投資3項,4項臨床治療技術企業(yè)轉讓。國家發(fā)明專利20余項。主編專著3部。
論文研究方向
以第一作者或通訊作者發(fā)表SCI論文160余篇,累計影響因子740余分。參與獲得省部級二等獎以上4項。2015年,成立了中國研究型醫(yī)院生物治療學專業(yè)委員會(二級學會),并擔任首屆主任委員。

趙海濤
北京協(xié)和醫(yī)院肝臟外科主任醫(yī)師
教授、博士生導師
兼任
2017年國家萬人計劃專家(領軍人才)
2016年國家青年科技創(chuàng)新領軍人才
2011年教育部新世紀優(yōu)秀人才
919腫瘤精準免疫治療公益基金創(chuàng)始人
北京大學校友會理事
歐美同學會醫(yī)師協(xié)會副秘書長
歐美同學會醫(yī)師協(xié)會青委會主委
歐美同學會醫(yī)師協(xié)會肝膽分會秘書長、副主委
科技部重大項目評審專家
HBSN(SCI收錄3.45)雜志副主編
WJG(IF:3.3)雜志編委
以通訊作者發(fā)表SCI論文超過70篇
總影響因子超過400分
作者介紹

豐愷超
中國人民解放軍總醫(yī)院生物治療科
主治醫(yī)師
北京醫(yī)學獎勵基金會肺癌醫(yī)學青年專家委員會委員
擅長常見腫瘤的免疫治療、靶向治療、I/II期臨床試驗
重點研究方向
1.免疫檢查點抑制劑治療晚期惡性腫瘤;
2.嵌合抗原受體(CAR)T細胞治療晚期實體腫瘤及惡性血液腫瘤;
3.表觀遺傳學藥物逆轉免疫檢查點抑制劑耐藥及增敏增效的研究。
論文發(fā)表情況
已發(fā)表SCI論文10余篇,其中以第一作者發(fā)表6篇,發(fā)表于Clin Cancer Res、J Hematol Oncol、Protein& Cell、Cellular & Molecular Immunology等期刊,影響因子>30

劉洋
解放軍總醫(yī)院生物治療科副主任醫(yī)師
血液腫瘤學碩士,腫瘤學博士
兼任
中國研究型醫(yī)院學會生物治療專業(yè)委員會委員
中國醫(yī)藥生物技術協(xié)會醫(yī)藥生物技術
臨床應用專委會委員
青年學組副組長
重點研究方向
專注于淋巴瘤、肝膽胰惡性腫瘤的表觀遺傳學藥物、免疫聯(lián)合方案和CAR-T細胞的臨床研究。
論文發(fā)表情況
以第一負責人承擔和參與院、國家級課題多項;專利2項;第一作者發(fā)表論文21篇,SCI論文11篇,單篇最高影響因子26.3分。參與編撰專著3部。獲解放軍總醫(yī)院科技進步二等獎1項。

梅 倩
醫(yī)學遺傳學博士
北京市科技新星
解放軍總醫(yī)院生物治療團隊副研究員
兼任
中國研究型醫(yī)院學會生物治療專業(yè)委員會青年委員
享受軍隊優(yōu)秀專業(yè)技術人才三類崗位津貼
入選解放軍總醫(yī)院首批新秀人才
院首批優(yōu)青培育對象
第六屆“總醫(yī)院十杰青年”
重點研究方向
主要從事腫瘤免疫治療相關調控機制與臨床轉化研究,作為主要負責人開展了低劑量去甲基化藥物為基礎綜合方案治療復發(fā)、難治實體瘤國際臨床試驗,目前已啟動10家三甲醫(yī)院參與的多中心臨床研究。
論文發(fā)表情況
以第一作者或通訊作者發(fā)表SCI論文14篇,總影響因子超80分,單篇最高10.199。主持國家及省部級課題5項及醫(yī)院人才類基金2項,資助金額300萬元;骨干承擔十三五國家重點研發(fā)計劃1項。
參考文獻:
[1] Ueno M, Ikeda M, Morizane C, Kobayashi S, Ohno I, Kondo S, et al. Nivolumab alone or in combination with cisplatin plus gemcitabine in Japanese patients with unresectable or recurrent biliary tract cancer: a non-randomised, multicentre, open-label, phase 1 study. Lancet Gastroenterol Hepatol.
Copyright?2021
深圳裕策生物科技有限公司 版權所有
粵ICP備16128839號

