題記:
自然規(guī)律在高維空間表述時(shí)會(huì)變得更為簡單和優(yōu)美。
——《超越時(shí)空》

二元悖論
新的技術(shù)平臺(tái)能夠解鎖新的認(rèn)知邊界,新的認(rèn)知能夠催生新技術(shù)。高通量測(cè)序(NGS)技術(shù)的出現(xiàn)為大規(guī)模解析腫瘤基因組信息提供了可能,同時(shí)分子表達(dá)譜技術(shù)使得對(duì)整塊混合組織的基因表達(dá)獲得前所未有的信息量。單細(xì)胞測(cè)序技術(shù)一定程度上加深了對(duì)組織中不同細(xì)胞類型及同類型細(xì)胞的亞群之間遺傳異質(zhì)性的理解。原位可視化技術(shù)如標(biāo)準(zhǔn)的免疫組織化學(xué)(IHC)染色和熒光原位雜交(FISH)可以獲得單個(gè)蛋白的組織原位表達(dá)信息。
然而,在當(dāng)前的每一次組織分析時(shí),研究人員都需要在形態(tài)成像技術(shù)和高通量分析技術(shù)間進(jìn)行兩難選擇,在信息維度、通量、分辨率和精密度之間做出取舍。在免疫腫瘤學(xué)研究中,這一悖論引發(fā)的局限性尤其明顯。腫瘤在不同樣本中的結(jié)構(gòu)、(免疫)細(xì)胞組成、豐度和分布方面具有高度異質(zhì)性,其所導(dǎo)致的腫瘤微環(huán)境的復(fù)雜性是當(dāng)前腫瘤免疫研究和轉(zhuǎn)化醫(yī)學(xué)所面臨的的重大挑戰(zhàn)。
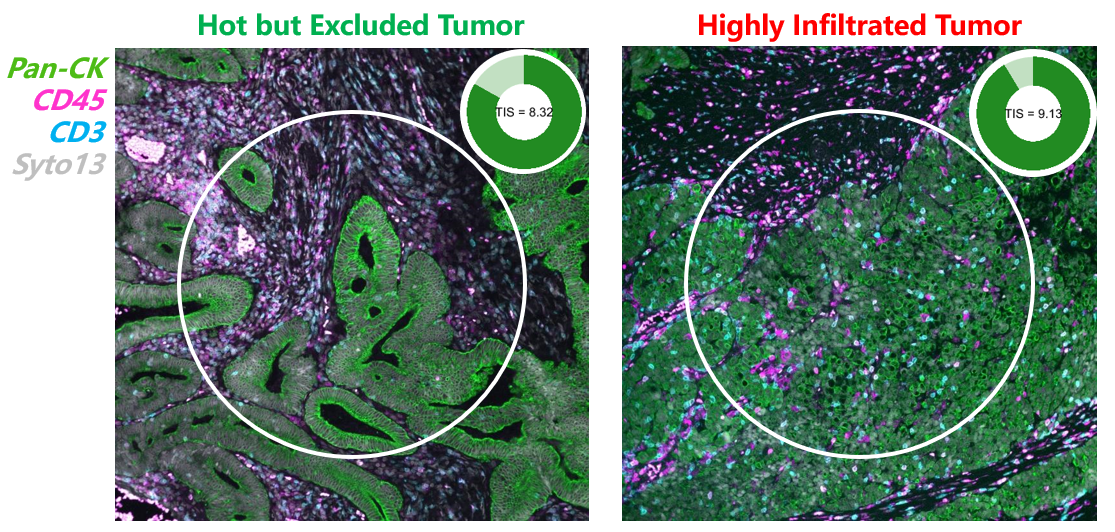
而基于當(dāng)前研究手段轉(zhuǎn)化出的結(jié)果應(yīng)用到臨床上,用于指導(dǎo)患者用藥或提示預(yù)后時(shí),總會(huì)遇到這樣那樣的問題。如下圖所示,兩位患者進(jìn)行了基于傳統(tǒng)基因表達(dá)檢測(cè)技術(shù)的,其TIS(Tumor Inflammation Signature)評(píng)分相近,但臨床預(yù)后存在著明顯的差異,經(jīng)過mIF技術(shù)進(jìn)行空間可視化標(biāo)記后才發(fā)現(xiàn)其腫瘤組織內(nèi)部免疫細(xì)胞的浸潤程度有明顯區(qū)別,腫瘤內(nèi)異質(zhì)性差異較大。腫瘤免疫研究中空間信息的重要性已經(jīng)日益顯現(xiàn)。
從混合物研究,升級(jí)到三維的空間
我們希望通過解析腫瘤區(qū)域內(nèi)免疫細(xì)胞亞群的詳細(xì)表征以提高我們對(duì)抗腫瘤免疫和對(duì)免疫檢查點(diǎn)抑制劑抵抗的理解,基于整塊混合組織的RNA表達(dá)數(shù)據(jù)的聚類分析或許可以獲得免疫細(xì)胞的分類和相對(duì)定量,然而卻要以犧牲重要的空間信息作為代價(jià)。我們還需要了解腫瘤和免疫細(xì)胞共定位,以加深對(duì)于生物標(biāo)志物的理解和識(shí)別,最終實(shí)現(xiàn)精準(zhǔn)免疫治療。腫瘤微環(huán)境的復(fù)雜性要求單張組織樣本切片產(chǎn)出多重信息,提高對(duì)于樣本切片特別是珍貴樣本的利用率。多色免疫熒光(mIF)利用TSA技術(shù)(Tyramide Signal Amplification)利用辣根過氧化酶(HRP)對(duì)靶蛋白進(jìn)行高密度原位標(biāo)記,使得單張切片的研究靶標(biāo)數(shù)可以多至6個(gè)。相比于標(biāo)準(zhǔn)的IHC染色不僅節(jié)約了樣本,還能實(shí)現(xiàn)多靶標(biāo)雙陽分析、免疫分型、細(xì)胞間距離分析、三級(jí)淋巴結(jié)構(gòu)分析(TLS)等。
而如何在組織樣本中進(jìn)行區(qū)域化和定量化蛋白質(zhì)和RNA的特征分析也被證實(shí)具有挑戰(zhàn)性。2019年發(fā)布的GeoMx DSP技術(shù)可在同一臨床樣本中的多個(gè)感興趣區(qū)域(ROI)一次性測(cè)定多達(dá)上百個(gè)蛋白,或1833個(gè)RNA靶標(biāo)或全轉(zhuǎn)錄組,同時(shí)實(shí)現(xiàn)保留空間原位信息前提下的高參數(shù)、多組學(xué)、高精度研究。以GeoMx DSP為代表的空間多組學(xué)技術(shù)被評(píng)為Nature Methods 2020年度技術(shù)和Nature 2022年七大顛覆性技術(shù)。

從三維的空間,升級(jí)為四維的時(shí)空
古希臘哲學(xué)家赫拉克利特曾說過:“人不能兩次踏入完全相同的河流。”河流奔涌向前的過程中,水早已不是原來的水了。世界上的萬事萬物,永遠(yuǎn)都處于不停變幻中,腫瘤當(dāng)然也不例外。腫瘤的進(jìn)化無異于一部人類進(jìn)化史的縮影,腫瘤細(xì)胞在分裂增殖中會(huì)不斷累積體細(xì)胞突變,在環(huán)境壓力(治療、人體免疫系統(tǒng)、腫瘤微環(huán)境)下,其中一些突變會(huì)給腫瘤細(xì)胞帶來更強(qiáng)的適應(yīng)性優(yōu)勢(shì),逃離人體免疫系統(tǒng)的監(jiān)視,帶來耐藥、復(fù)發(fā)、轉(zhuǎn)移的終極難題。在屢戰(zhàn)屢敗中我們獲得的教訓(xùn)是,單點(diǎn)的信息不足以指導(dǎo)這場(chǎng)對(duì)抗腫瘤的持久戰(zhàn),只有基于動(dòng)態(tài)、多點(diǎn)地監(jiān)測(cè)信息不斷調(diào)整對(duì)抗策略才能獲得更高的勝率。
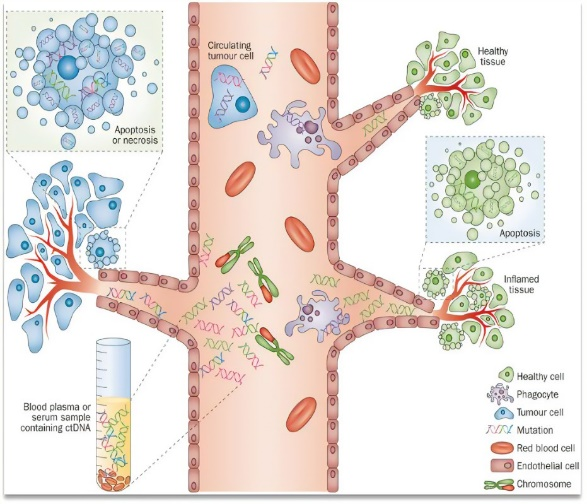
外周循環(huán)系統(tǒng)中蘊(yùn)涵著大量的過程信息,血液樣本通過非侵入性方式采集,相對(duì)組織更易于獲取,利于多次檢測(cè)。循環(huán)腫瘤DNA(ctDNA)可以表征腫瘤基因組特征(突變、數(shù)量、異質(zhì)性)和評(píng)估微小殘留病灶(定量數(shù)值),可以提示預(yù)后并指導(dǎo)下一步治療策略制定。包括血清癌胚抗原、甲胎蛋白在內(nèi)的循環(huán)蛋白質(zhì)是當(dāng)前臨床上常用的腫瘤標(biāo)志物,用免疫學(xué),生物學(xué)以及化學(xué)的方法來檢測(cè)到,但受到靈敏度、通量的局限限制。Olink獨(dú)有的鄰位延伸分析(PEA)技術(shù),將蛋白濃度信號(hào)轉(zhuǎn)換成核酸信號(hào),從而實(shí)現(xiàn)飛克級(jí)、3000多重的蛋白檢測(cè),打破傳統(tǒng)蛋白檢測(cè)的技術(shù)壁壘,輕松實(shí)現(xiàn)微量血漿樣本的高通量、高靈敏度的蛋白質(zhì)組學(xué)檢測(cè)。在準(zhǔn)確檢出高豐度蛋白的同時(shí),也不會(huì)錯(cuò)過具有生物標(biāo)志物潛能的低豐度蛋白。
定義腫瘤免疫時(shí)空組學(xué)
裕策生物深耕腫瘤免疫領(lǐng)域近七載,不斷在“讓腫瘤免疫更有效”方向上尋求本質(zhì)解。通過自身大量科研實(shí)踐,對(duì)于腫瘤免疫的復(fù)雜性和傳統(tǒng)研究方法的局限性有著深刻的理解。隨著研究的深入和技術(shù)平臺(tái)不斷發(fā)展,裕策生物從腫瘤基因組和腫瘤微環(huán)境兩個(gè)角度對(duì)多維技術(shù)平臺(tái)進(jìn)行了前瞻性的布局。

在空間和時(shí)間維度引入更多平臺(tái)之間的協(xié)作,并提出腫瘤免疫時(shí)空組學(xué)的概念,即通過對(duì)多平臺(tái)多維度的創(chuàng)新研究方法進(jìn)行整合,實(shí)現(xiàn)腫瘤免疫研究的“空間聚焦”和“動(dòng)態(tài)檢測(cè)”,通過臨床可及的樣本一站式獲取高通量、高精密度、空間原位、多重?cái)?shù)、多時(shí)點(diǎn)監(jiān)測(cè)數(shù)據(jù)。
在空間維度,借助空間轉(zhuǎn)錄組、空間蛋白組、多色免疫熒光等技術(shù)來解析腫瘤微環(huán)境空間層面的信息,使抗腫瘤免疫反應(yīng)主戰(zhàn)場(chǎng)上的戰(zhàn)況清晰可見。
在時(shí)間維度,借助單細(xì)胞測(cè)序、循環(huán)蛋白質(zhì)組學(xué)檢測(cè)以及ctDNA NGS檢測(cè)技術(shù)來解析不同時(shí)間點(diǎn)的腫瘤基因組特征信息和細(xì)胞間通訊,建立抗腫瘤免疫的情報(bào)系統(tǒng)。
裕策生物通過組建這套國內(nèi)獨(dú)有、國際前沿的為腫瘤免疫方向量身定制的時(shí)空組學(xué)科研平臺(tái),助力研究思路的開拓,研究水平的提升,把對(duì)腫瘤免疫的認(rèn)知升維到前所未有的新境界,并通過轉(zhuǎn)化醫(yī)學(xué)最終實(shí)現(xiàn)臨床應(yīng)用,讓腫瘤免疫治療更精準(zhǔn)有效,讓更多患者獲益。

共同實(shí)踐驗(yàn)證未來發(fā)展方向
多平臺(tái)多維度的整合創(chuàng)新性研究方法,在當(dāng)前的腫瘤免疫研究中已經(jīng)成為一種趨勢(shì),隨著越來越多的研究成果得到發(fā)表,進(jìn)一步印證了“腫瘤免疫時(shí)空組學(xué)”這一概念的可行性。
Case 1
喬治敦大學(xué)醫(yī)院研究團(tuán)隊(duì)利用NanoString的GeoMx? Digital Spatial Profiler (DSP)技術(shù)和NanoString nCounter PanCancer IO 360?(IO 360)檢測(cè)Panel,對(duì)多個(gè)HER2+乳腺癌患者的原發(fā)灶和轉(zhuǎn)移灶的TME進(jìn)行分析,以了解在HER2+乳腺癌患者的診療過程中腫瘤復(fù)發(fā)或轉(zhuǎn)移后的免疫微環(huán)境變化。
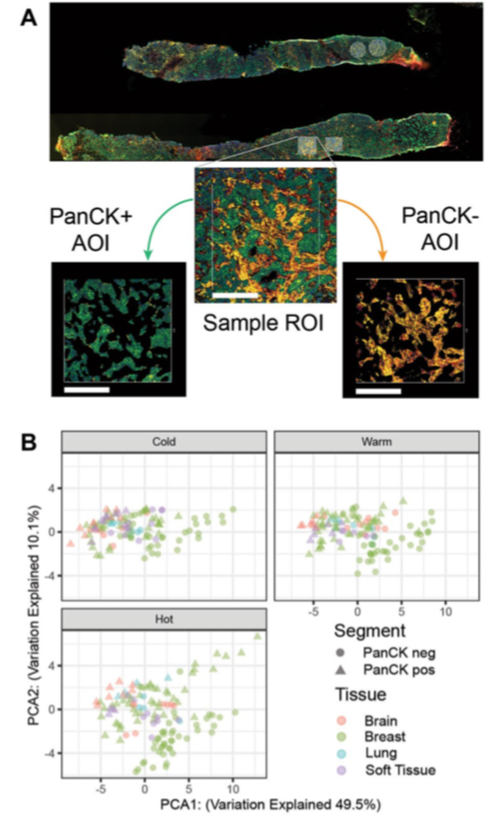
Citation:Schlam I, et al. The tumor immune microenvironment of primary and metastatic HER2- positive breast cancers utilizing gene expression and spatial proteomic profiling. J Transl Med. 2021 Nov 27;19(1):480. doi: 10.1186/s12967-021-03113-9.
詳細(xì)解讀:《文獻(xiàn)解讀|空間蛋白組學(xué)助力乳腺癌腫瘤微環(huán)境研究》
Case 2
MIT和哈佛大學(xué)Broad研究所的知名生物信息專家Aviv Regev團(tuán)隊(duì)利用單細(xì)胞RNA測(cè)序 (scRNA-seq)、NanoString的GeoMx Digital Spatial Profiler (DSP)以及遺傳和藥理學(xué)干擾技術(shù)對(duì)SyS的免疫微環(huán)境和空間生態(tài)系統(tǒng)進(jìn)行研究,揭示了免疫逃逸和致癌過程之間的相互作用,并針對(duì) SyS 提出了潛在的新治療策略。
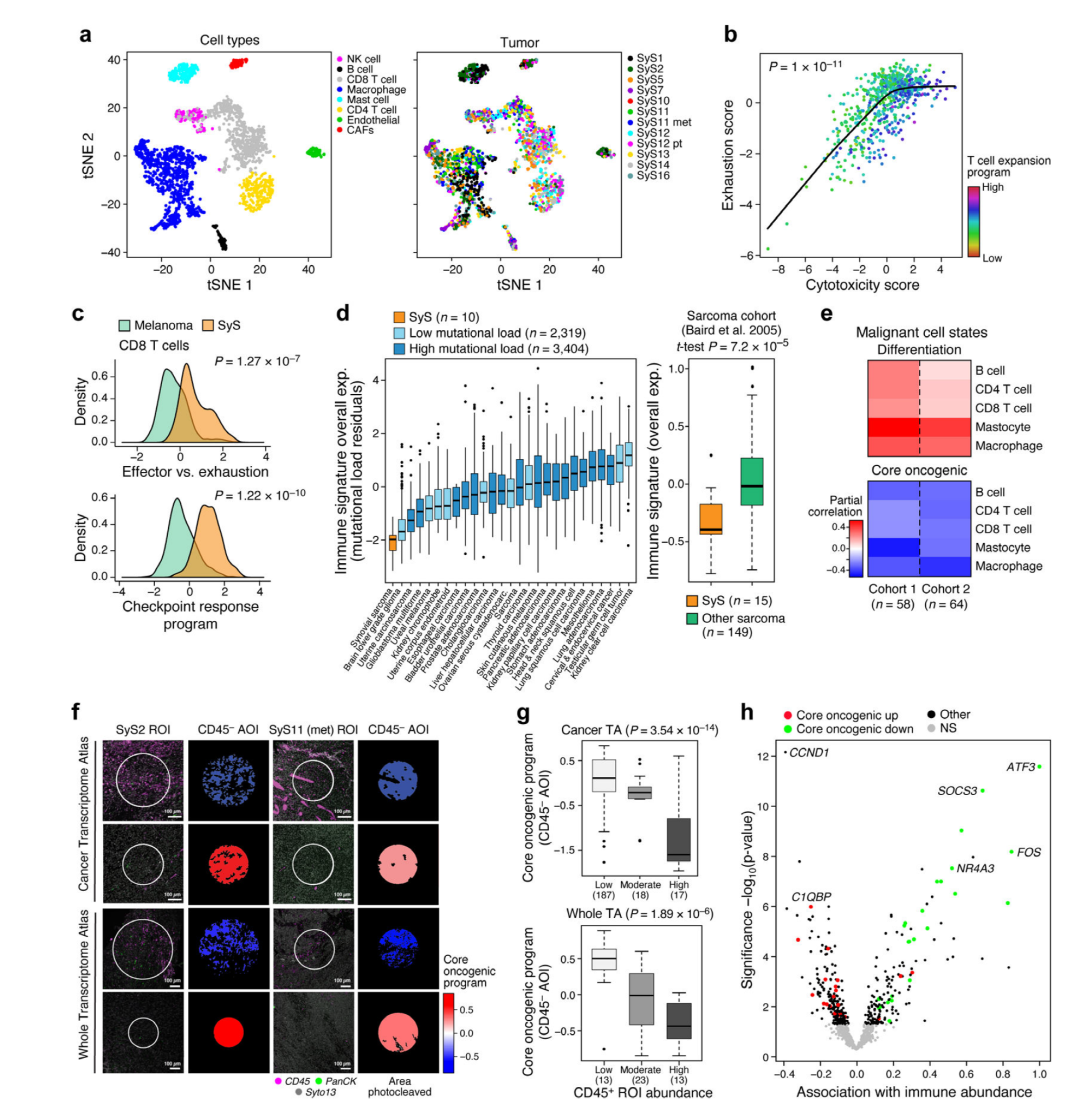
Citation:Jerby-Arnon L, et al. Opposing immune and genetic mechanisms shape oncogenic programs in synovial sarcoma. Nat Med. 2021 Feb;27(2):289-300. doi: 10.1038/s41591-020-01212-6.
詳細(xì)解讀:《文獻(xiàn)解讀|空間轉(zhuǎn)錄組聯(lián)合單細(xì)胞測(cè)序技術(shù)揭秘滑膜肉瘤核心致癌程序》
Case 3
麻省理工學(xué)院團(tuán)隊(duì)從胰腺癌特異性新抗原出發(fā),在胰腺癌中發(fā)現(xiàn)了功能類似于PD-1/PD-L1的剎車系統(tǒng)—CD155/TIGIT會(huì)導(dǎo)致PDAC免疫逃逸。在臨床前小鼠模型中開發(fā)了一種免疫治療策略—PD-1抑制劑+TIGIT抑制劑+CD40激動(dòng)劑,可以消除小鼠的胰腺腫瘤,為胰腺癌免疫治療帶來新希望。研究者應(yīng)用空間蛋白組技術(shù)結(jié)合單細(xì)胞測(cè)序等多種技術(shù),從組織空間等多角度深刻闡釋了該策略背后的分子機(jī)制。
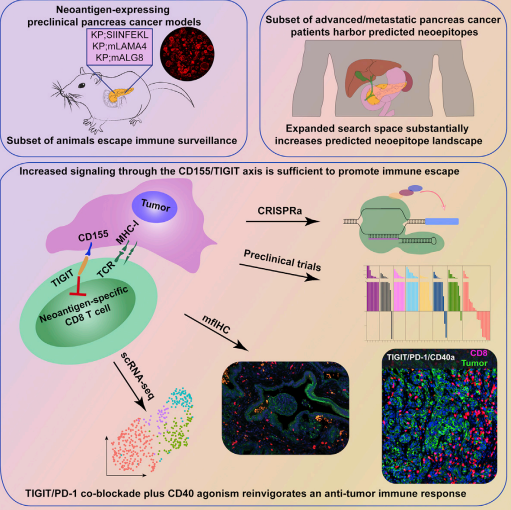
Citation:Freed-Pastor WA, et al. The CD155/TIGIT axis promotes and maintains immune evasion in neoantigen-expressing pancreatic cancer. Cancer Cell. 2021 Oct 11;39(10):1342-1360.e14. doi: 10.1016/j.ccell.2021.07.007.
詳細(xì)解讀:《文獻(xiàn)解讀|空間蛋白組聯(lián)合單細(xì)胞測(cè)序技術(shù)揭秘胰腺癌免疫逃逸新機(jī)制》
Case 4
耶魯大學(xué)醫(yī)學(xué)院病理學(xué)系教授David L. Rimm 團(tuán)隊(duì)聯(lián)合NanoString科技公司應(yīng)用空間蛋白組(GeoMx? DSP) 結(jié)合多色免疫熒光 (mIF) 技術(shù)在NSCLC中探究對(duì)PD-1檢查點(diǎn)抑制劑響應(yīng)的生物標(biāo)志物。研究結(jié)果證實(shí)基質(zhì)區(qū)高密度的CD56+免疫細(xì)胞的患者有更久的無進(jìn)展生存期(PFS)及總生存期(OS) 相關(guān)。
此項(xiàng)中試規(guī)模的發(fā)現(xiàn)隊(duì)列展示了基于DSP和nCounter平臺(tái)的空間蛋白組學(xué)研究聯(lián)合mIF技術(shù)在NSCLC中鑒定對(duì)PD-1檢查點(diǎn)抑制劑響應(yīng)的空間相關(guān)生物標(biāo)志物的應(yīng)用潛力。

Citation: Zugazagoitia J, et al. Biomarkers Associated with Beneficial PD-1 Checkpoint Blockade in Non-Small Cell Lung Cancer (NSCLC) Identified Using High-Plex Digital Spatial Profiling. Clin Cancer Res. 2020 Aug 15;26(16):4360-4368. doi: 10.1158/1078-0432.CCR-20-0175.
詳細(xì)解讀:《文獻(xiàn)解讀|DSP+nCounter+mIF如何發(fā)表高分文章?》
Case 5
中山大學(xué)孫逸仙紀(jì)念醫(yī)院劉潔瓊教授團(tuán)隊(duì)發(fā)起的探索艾瑞布林聯(lián)合卡瑞利珠單抗以及阿帕替尼治療aTNBC患者的多中心、單臂的臨床試驗(yàn)結(jié)果正式發(fā)表在Nature Communications(IF=14.919)。裕策生物負(fù)責(zé)該研究中mIF與olink的檢測(cè)及數(shù)據(jù)解析工作。該前瞻性研究證實(shí)了卡瑞利珠單抗聯(lián)合阿帕替尼和艾瑞布林在既往接受過治療的aTNBC患者中表現(xiàn)出良好的安全性和有效性,即使PD-L1陰性腫瘤患者或那些接受了包括免疫檢查點(diǎn)抑制劑在內(nèi)的多種不成功的全身治療的患者,仍然可以從這種聯(lián)合治療方案中受益。

Citation: Liu J, et al. Multicenter phase II trial of Camrelizumab combined with Apatinib and Eribulin in heavily pretreated patients with advanced triple-negative breast cancer. Nat Commun. 2022 May 31;13(1):3011. doi: 10.1038/s41467-022-30569-0.
詳細(xì)解讀:《文章發(fā)表|多組學(xué)平臺(tái)助力aTNBC免疫聯(lián)合化療及抗血管生成藥物研究獲得新進(jìn)展》
裕策生物——腫瘤免疫科研優(yōu)選合作伙伴
裕策生物作為腫瘤精準(zhǔn)免疫診療整體解決方案提供商,致力于為腫瘤免疫領(lǐng)域的基礎(chǔ)醫(yī)學(xué)、臨床研究和轉(zhuǎn)化醫(yī)學(xué)研究者提供國際前沿的臨床轉(zhuǎn)化科研服務(wù)。臨床樣本友好的基因表達(dá)譜檢測(cè)、免疫微環(huán)境多重蛋白檢測(cè)、高通量循環(huán)蛋白檢測(cè)提供了海量、充分、多角度信息,結(jié)合強(qiáng)大的空間多組學(xué)分析技術(shù),組成從生物標(biāo)志物/靶點(diǎn)發(fā)現(xiàn)、驗(yàn)證到轉(zhuǎn)化的整體解決方案,促進(jìn)精準(zhǔn)醫(yī)療和個(gè)體化治療方案的制定、發(fā)展與實(shí)施。

Copyright?2021
深圳裕策生物科技有限公司 版權(quán)所有
粵ICP備16128839號(hào)

