導(dǎo)讀

2021年1月28日,裕策生物的“基于免疫編輯的優(yōu)化新抗原負(fù)荷模型用于預(yù)測(cè)免疫檢查點(diǎn)治療響應(yīng)和預(yù)后”的研究項(xiàng)目以featured poster形式發(fā)表在WCLC2020會(huì)議上。下面,小編就為大家詳細(xì)解讀這項(xiàng)研究結(jié)果。
題目
An Optimized Neoantigen Load Model Based on Immune Editing to Predict Response and Prognosis of Immune Checkpoint Therapy
背景
以CTLA-4、PD-1和PD-L1為靶點(diǎn)的免疫檢查點(diǎn)抑制劑(ICIs)可促進(jìn)T細(xì)胞的抗腫瘤反應(yīng),多款藥物已經(jīng)在國(guó)內(nèi)外獲批。但是免疫治療也存在有效人群不高、耐藥、超進(jìn)展等問(wèn)題,這使得迫切需要尋找有效的生物標(biāo)記物來(lái)選擇潛在的應(yīng)答者。目前被廣泛接受的生物標(biāo)志物(例如PD-L1、TMB)其實(shí)并不夠完善,一些TMB較低或PD-L1陰性的患者仍能從免疫檢查點(diǎn)抑制劑中獲益。最近越來(lái)越多研究發(fā)現(xiàn),新生抗原可以在免疫選擇的壓力下通過(guò)多種免疫編輯的機(jī)制引起腫瘤免疫逃逸。因此,整合基因組特征和免疫編輯的方法可能會(huì)更準(zhǔn)確地捕獲免疫檢查點(diǎn)抑制劑期間癌癥和免疫逃逸之間的相互作用,并解釋對(duì)治療的反應(yīng)。
腫瘤的免疫編輯理論
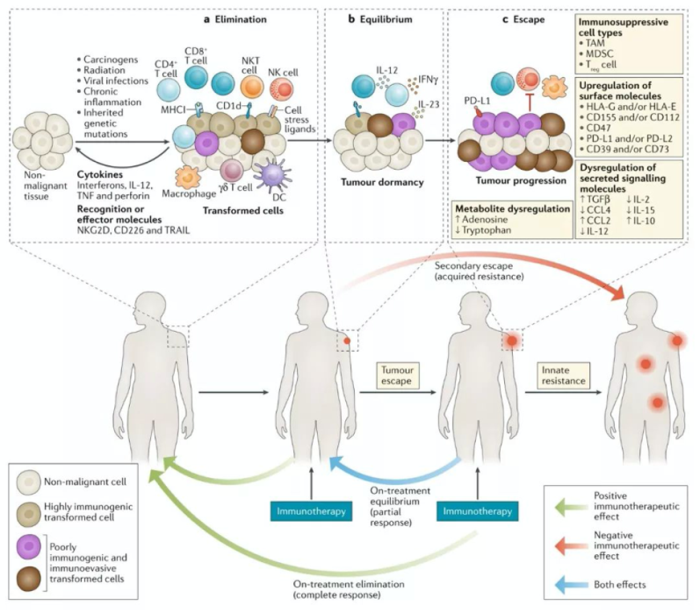
在介紹該研究前,需要引入一個(gè)重要概念,即腫瘤免疫編輯理論(Cancer Immuno-editing)。腫瘤細(xì)胞在機(jī)體內(nèi)的發(fā)生、發(fā)展是與免疫系統(tǒng)相互作用的動(dòng)態(tài)過(guò)程,免疫系統(tǒng)不僅具有清除腫瘤細(xì)胞的能力,而且還具有促進(jìn)腫瘤生長(zhǎng)的作用[1]。
免疫編輯共分為三個(gè)階段:清除(Elimination),平衡(Equilibrium),逃逸(Escape)。
? 清除階段
固有免疫和特異性免疫協(xié)同作用,DC、NK、巨噬細(xì)胞、效應(yīng)T細(xì)胞等識(shí)別并消滅腫瘤細(xì)胞。
? 平衡階段
個(gè)別的腫瘤細(xì)胞克隆因其免疫原性低或其他原因,躲過(guò)了清除階段,腫瘤進(jìn)入平衡階段,即腫瘤生長(zhǎng)停滯。一般認(rèn)為主要由特異性免疫維持這個(gè)平衡,而固有免疫機(jī)制不參與該階段。
? 逃逸階段
腫瘤細(xì)胞基因組是非常不穩(wěn)定的,隨著免疫系統(tǒng)持續(xù)的選擇壓力,越來(lái)越多的癌細(xì)胞克隆擁有了躲避免疫系統(tǒng)識(shí)別或消除的能力,如MHC和/或腫瘤抗原肽表達(dá)缺失,腫瘤生長(zhǎng)逐漸不受控制,最終發(fā)病[2]。
免疫治療ioTNL算法
根據(jù)腫瘤免疫編輯理論,具有免疫清除能力的腫瘤克隆可以被T細(xì)胞識(shí)別并清除,而經(jīng)過(guò)免疫編輯的腫瘤克隆一般會(huì)具有較高的突變載荷,會(huì)通過(guò)HLA基因雜合性缺失或減少新生抗原呈遞通路的基因表達(dá)等機(jī)制下逃避免疫監(jiān)控。
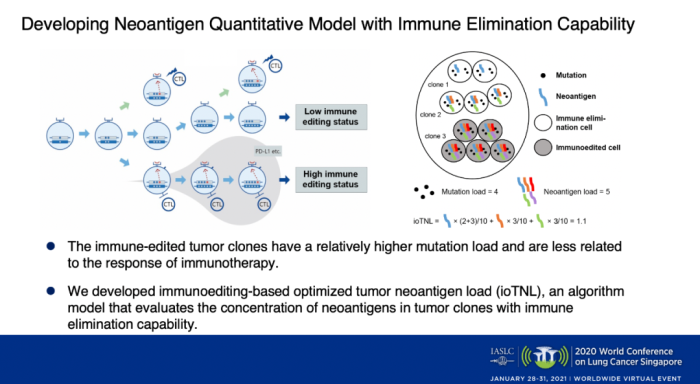
根據(jù)免疫編輯理論,我們開(kāi)發(fā)了一個(gè)基于免疫編輯優(yōu)化的腫瘤新生抗原負(fù)荷算法(ioTNL),該算法模型可評(píng)估具有免疫消除功能的腫瘤克隆中新生抗原的豐度。ioTNL的計(jì)算:排除掉經(jīng)過(guò)免疫編輯的克隆所產(chǎn)生的新生抗原負(fù)荷,而將來(lái)自免疫清除狀態(tài)克隆的新生抗原按照其所占的腫瘤細(xì)胞豐度相加。
結(jié)果
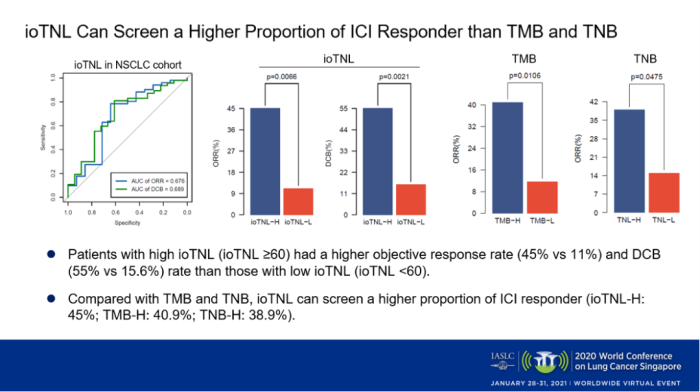
首先,我們?cè)?5例經(jīng)過(guò)免疫治療的NSCLC隊(duì)列中探索ioTNL的作用,發(fā)現(xiàn)臨床獲益患者的ioTNL明顯高于無(wú)響應(yīng)患者(p=0.045),并且高ioTNL(≥60)的患者有較高的客觀緩解率(p<0.01)。與TMB和TNB相比,ioTNL能夠篩選出更高比例響應(yīng)免疫治療的患者(ioTNL-H: 45%; TMB-H: 40.9%; TNB-H: 38.9%)。
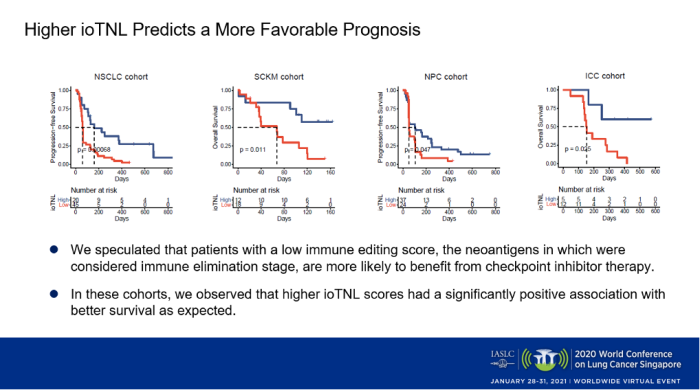
我們還在另外三個(gè)ICIs治療的隊(duì)列中(黑色素瘤,鼻咽癌和肝內(nèi)膽管癌)驗(yàn)證了ioTNL。同樣地,我們發(fā)現(xiàn)ioTNL表現(xiàn)出了其對(duì)免疫治療療效的預(yù)測(cè)性能。在預(yù)后水平上,我們也觀察到ioTNL評(píng)分高的患者在所有四個(gè)隊(duì)列中都與更好的生存顯著相關(guān)(p<0.05)。
結(jié)論
本研究通過(guò)鑒定具有免疫清除功能的腫瘤克隆,開(kāi)發(fā)了一個(gè)基于免疫編輯優(yōu)化的腫瘤新抗原負(fù)荷模型(ioTNL),探索了ioTNL與腫瘤免疫治療響應(yīng)之間的關(guān)系。本研究在四個(gè)免疫治療的隊(duì)列中發(fā)現(xiàn)并驗(yàn)證了高ioTNL評(píng)分與臨床客觀緩解相關(guān),是患者的重要預(yù)后因素。而且ioTNL相較于TMB和TNB能夠篩選出更高比例響應(yīng)免疫治療的患者也表明了腫瘤免疫編輯在T細(xì)胞的抗腫瘤反應(yīng)中起到了不容忽視的抑制作用,影響了患者對(duì)ICIs的應(yīng)答。所以ioTNL有望成為預(yù)測(cè)患者免疫檢查點(diǎn)抑制劑治療療效和預(yù)后的新biomarker。
Copyright?2021
深圳裕策生物科技有限公司 版權(quán)所有
粵ICP備16128839號(hào)

