2020年11月9日,美國病理學家協會(CAP,College of American Pathologists)公布了2020上半年CAP-PT(Proficiency Testing,PT)的“CFDNA-A”項目能力驗證評估報告。裕策生物旗下深圳裕康醫學檢驗實驗室(以下簡稱:裕康醫學實驗室)的檢測結果與預期結果100%一致,裕策生物以滿分的優異成績通過CAP-CFDNA室間質評。

CFDNA項目是CAP于2018年新開展的,針對全球范圍的基因檢測實驗室,基于液體活檢技術檢測基因變異能力的測評項目。該項目包含3個樣本,涉及 BRAF / EGFR / KRAS / IDH1 / NRAS 基因的多個檢測位點,根據各實驗室報告的該變異的LOD(檢測限)值進行評估。
裕康醫學實驗室本次PT結果與CAP公布的標準結果完全一致,如下圖所示:
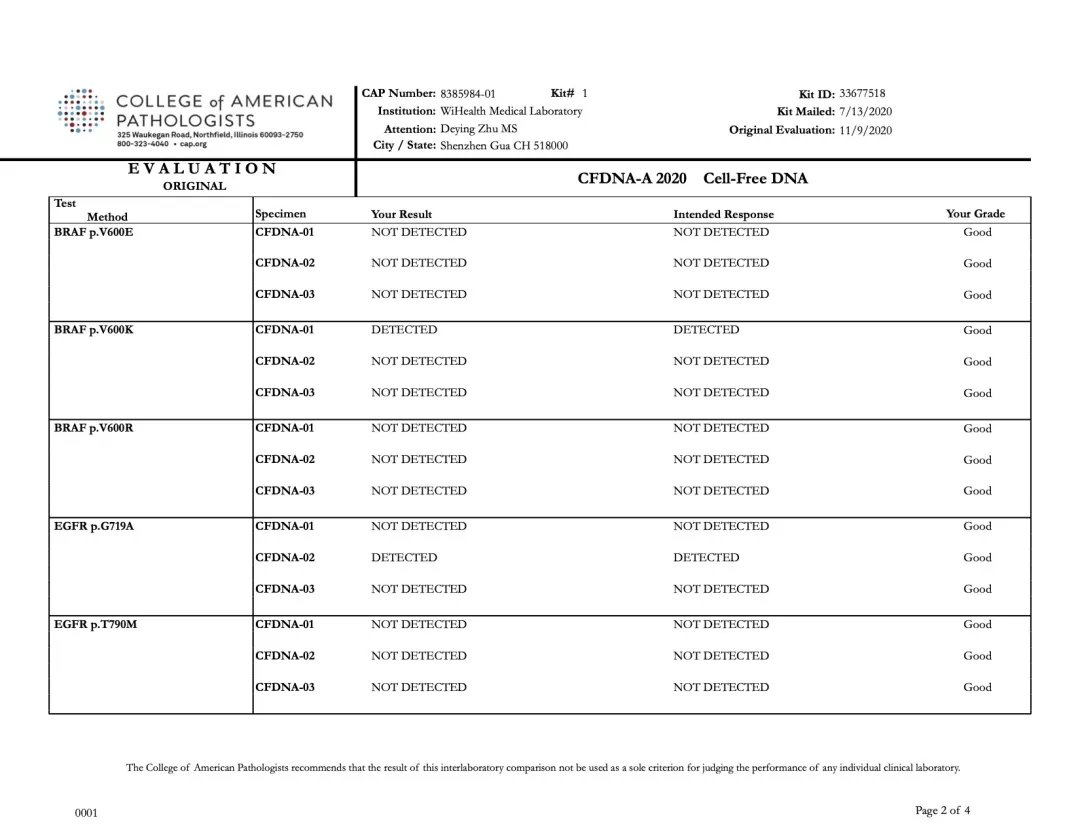


裕策生物“CFDNA-A” 項目檢測結果
這是裕策生物繼通過國家衛生健康委臨床檢驗中心(NCCL)、歐洲分子基因診斷質量聯盟(EMQN)、美國病理學家協會(CAP)多項質量評價后的又一佳績!此次滿分通過CAP能力驗證計劃,再次證明了裕策生物擁有過硬的技術實力、嚴謹的操作流程、卓越的產品設計。同時,也標志著裕康醫學實驗室已經躋身國際一流的醫學檢驗實驗室行列,實驗室質量管理體系、實驗技術水平、信息分析等各方面的規范性和準確性均得到國際認證!
未來,裕策生物將一如既往地保持國際一流水準,以更嚴格標準要求自身,繼續積極參加國內及國際上各類質評考核,再接再厲、不斷開拓,為醫生和患者提供高質量的產品和專業的服務!
關于美國病理學會
美國病理學家協會(College of American Pathologists,CAP)是世界最大的病理學家組織,成立于1947年,被認為是國際上最具權威的臨床檢測實驗室認可機構之一,也是被證明了的一種有效的同行評估模式,堪稱為行業的國際“黃金標準”,FDA明確要求必須是來自CAP認證的實驗室實驗數據。CAP的一個重要內容就是向世界各地參與的實驗室開展能力驗證活動(Proficiency Testing,PT也稱為室間質評)。
關于裕康醫學實驗室
裕康醫學實驗室占地1500平方米,是以臨床需求為中心、以腫瘤精準免疫檢測為特色、以精準用藥為導向的綜合檢測中心。裕康醫學實驗室已經通過廣東省臨床檢驗中心臨床基因擴增檢驗實驗室技術審核,按照美國病理學家協會(CAP)及ISO9001質量管理體系建設并持續完善實驗室質量管理體系,在生產中使用被嚴格驗證過的SOP(標準操作流程),其中設立了包含從組織病理檢測到報告解讀全流程數十項質控點,保障每一份臨床樣本檢測的準確性。目前,裕康醫學實驗室已經通過歐洲分子基因診斷質量聯盟(EMQN)和國家衛生部臨檢中心組織的多項室間質評項目,充分證明裕康醫學實驗室的檢測水平達到了國際一流水準,展現了其作為精準醫療行業領先企業的技術實力和完善的質量體系。
裕策生物近期獲得的質量認證
2019年7月 通過CAP-NGSST室間質評
2019年10月 通過德國萊茵TUV權威認證機構測評
2019年10月 通過NCCL室間質評
2019年10月 通過CAP-EGFR室間質評
2019年11月 通過EMQN室間質評
2020年1月 通過CAP-NGSST室間質評
2020年3月 通過EMQN室間質評
2020年5月 通過5項NCCL室間質評
2020年8月 通過CAP-MTP室間質評
2020年8月 通過NCCL室間質評
2020年8月 通過NCCL室間質評
2020年9月 通過CAP-NGSST室間質評
Copyright?2021
深圳裕策生物科技有限公司 版權所有
粵ICP備16128839號

