撥開迷霧:TESLA在cell發(fā)布新生抗原預測算法模型和核心參數
2020-12-16
【 返回列表 】
腫瘤發(fā)生發(fā)展過程會產生許多基因突變,這些突變后的片段在轉錄和翻譯后形成的正常組織和細胞中所沒有的多肽段被稱為neoantigen(新生抗原)。當新生抗原被HLA I類分子呈遞到腫瘤細胞表面后就可能引發(fā)免疫系統的抗腫瘤反應,由于新生抗原的特異性,一般不會引起機體出現免疫耐受以及自身免疫反應 ,因此它被研究人員認為是極具潛力的腫瘤治療靶點。2017年的一項來自Nature的研究曾經報道[1],在人體內,新生抗原疫苗可以誘導特異性的抗腫瘤T細胞產生,并導致患者體內黑色素瘤的大幅度消退,并且針對非突變多肽很少產生免疫脫靶反應。
然而,從有限的樣本中精確預測新生抗原的免疫原性仍面臨著挑戰(zhàn)。許多鑒別治療相關新生抗原的方法結合了腫瘤測序與生物信息學算法,從而推斷出腫瘤表位免疫原性的規(guī)律。但是,鑒于腫瘤細胞的突變具有復雜性和個體化的特征,所得出的結果很容易受到樣本自身偏差的影響。此外,新生抗原免疫原性的預測還會受到腫瘤種類、病灶部位、人種等因素的影響。從腫瘤新生抗原免疫療法開發(fā)所需的規(guī)模和通量來看,這可能并不是一個科研機構或者一個生物公司可以全部完成的。

在此背景下,為了全面、無偏差地分析腫瘤表位免疫原性的關鍵參數,加速這一領域的迅速發(fā)展,美國國家癌癥中心(CRI)和帕克癌癥免疫治療研究所(PICI)聯合紀念斯隆凱特琳癌癥中心(MSKCC)、MD 安德森癌癥中心等36家新生抗原研究機構成立了國際新生抗原篩查聯盟(Tumor Epitope SeLection Alliance,簡稱:TESLA),該聯盟旨在建立全球新生抗原檢測的算法和標準。裕策生物作為國內第一家聯盟成員,協力聯盟建立更精準的抗癌靶點預測體系,推進腫瘤個體化免疫治療的研究和應用。近日,腫瘤新生抗原篩選聯盟的科學家們的最新研究成果發(fā)表于Cell ,該研究成果發(fā)現了可以更好地預測哪些新生抗原可以激活治療癌癥作用的算法模型和核心參數,這無疑將催生新一代更有效、更個性化的癌癥免疫療法,也代表著基于新生抗原的個體化免疫療法新時代已經到來!
該研究使用了TESLA聯盟的6對試者樣本(3個轉移性黑色素瘤患者和3個非小細胞肺癌患者)。具體其流程為:1.TESLA向每個團隊提供相同的個體腫瘤外顯子組測序(WES),RNAseq測序和臨床HLA分型數據;
2.各個團隊利用該數據分別預測新生抗原表位,并對新生抗原表位與相關MHC I的結合及引發(fā)免疫反應能力排序;
3.對預測中高排位的多肽(pMHC)做體外結合測試和多肽免疫反應測試。通過這一流程TESLA團隊成員能夠相應的優(yōu)化他們的預測算法。
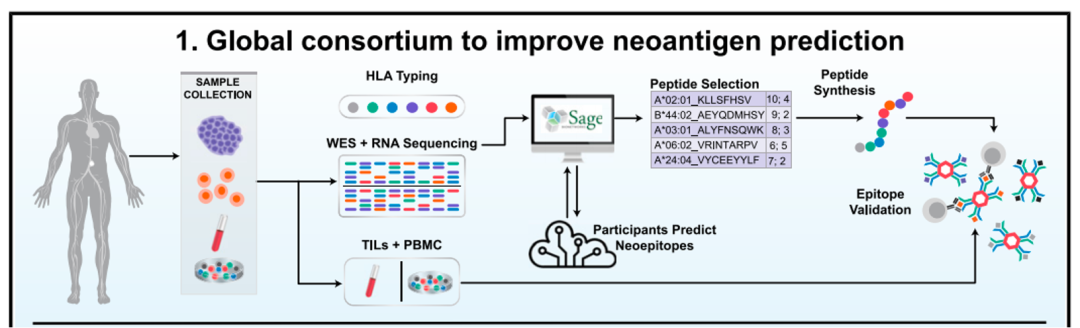
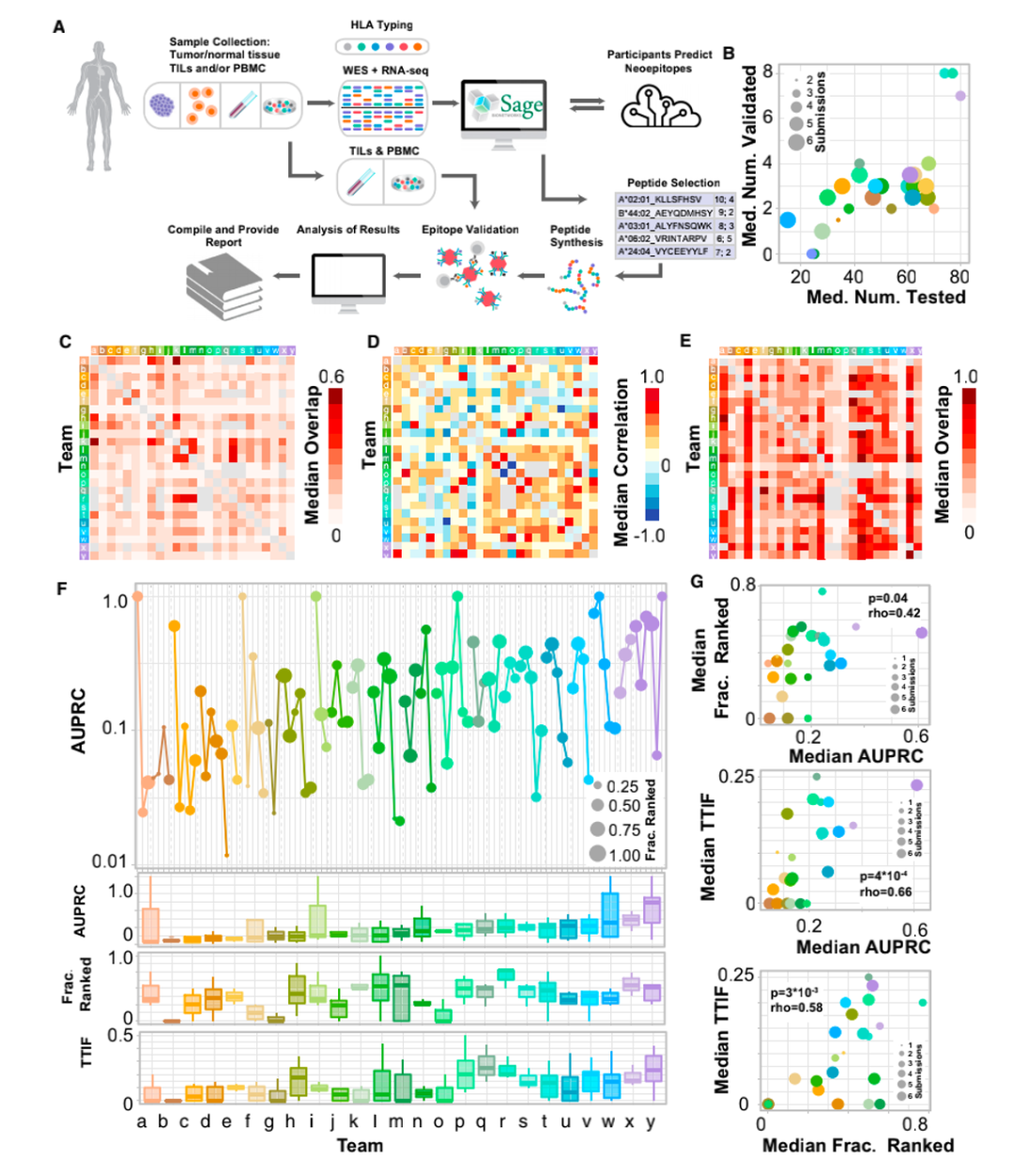
新生抗原預測流程
最終,研究人員對其中排名較高的608個多肽通過基于pMHC多聚體的檢測方法檢測免疫原性,結果顯示只有37個(6%)具有免疫原性。分析每組TESLA團隊前100名pMHC的重疊部分,發(fā)現大多數情況下,團隊之間的重疊很少(少于20%),重疊的中位值如圖1C所示。但是,分析排名前100的pMHC與另一個團隊的整個列表之間的重疊(圖1E),重疊的中位數要大得多(32%),這表明TESLA參與者在預測中產生差異的部分原因是表位過濾和排名的差異。圖1
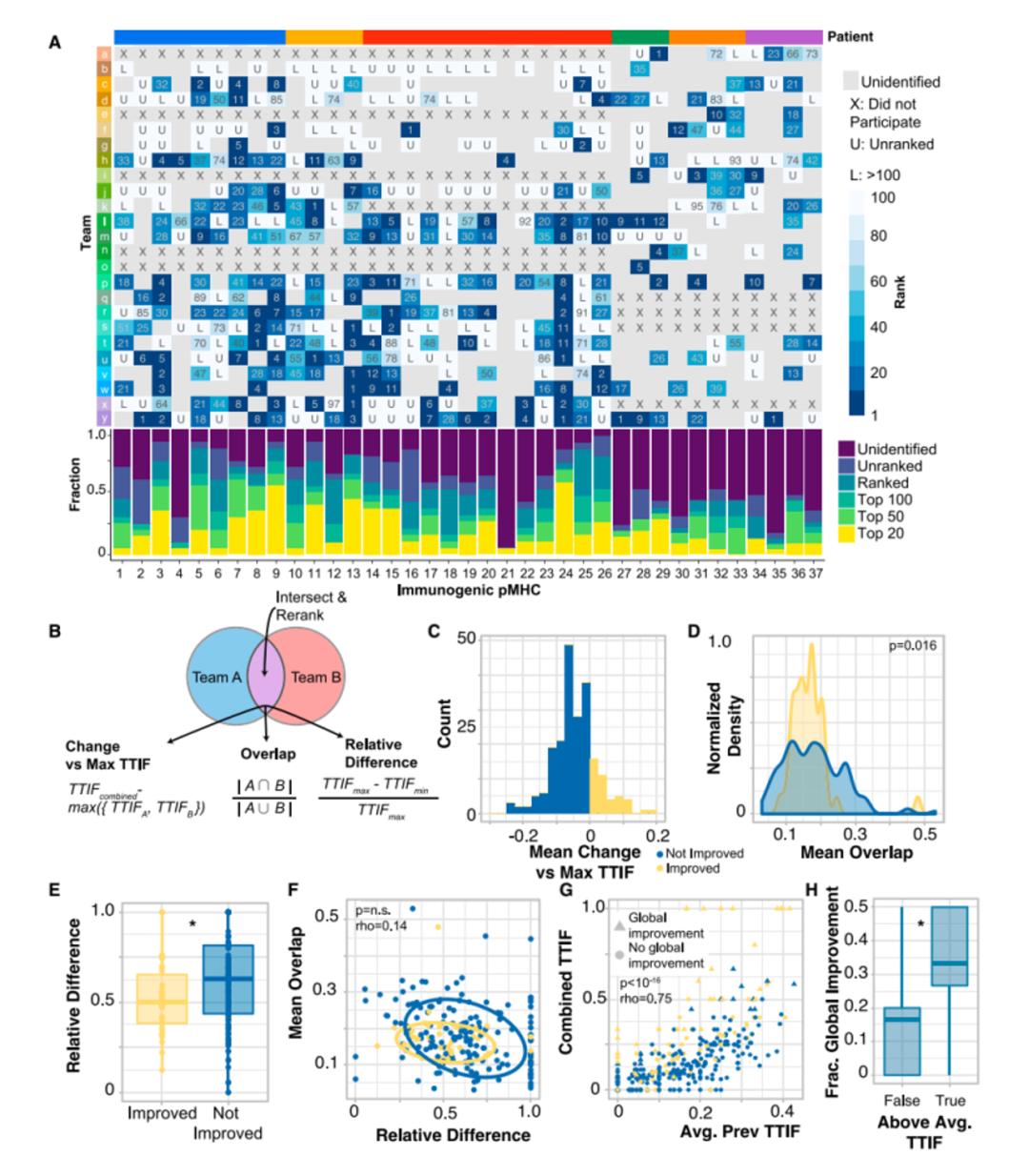
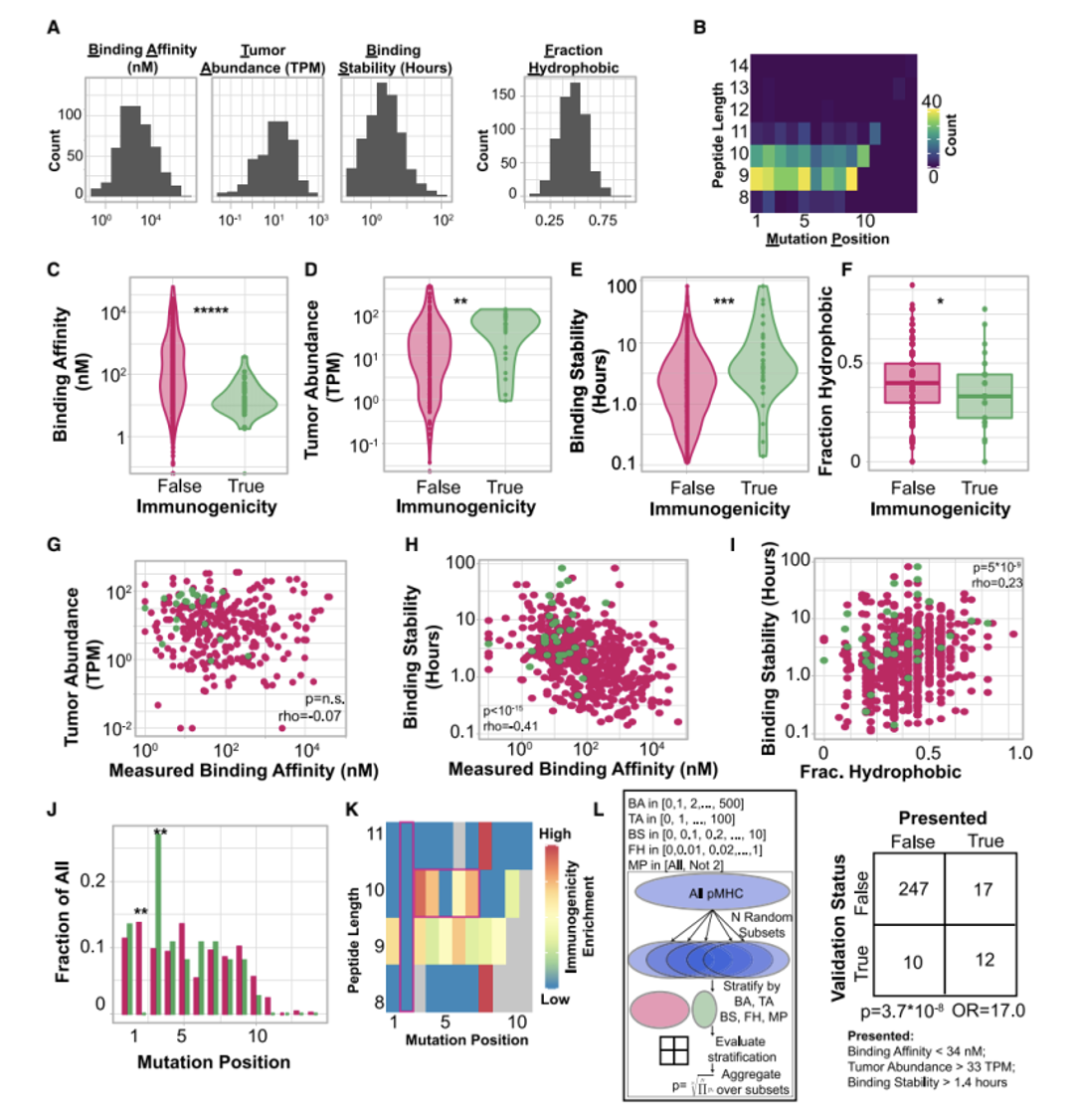
值得注意的是,每個團隊在前100名的排序中都預測正確了1至20個具有免疫原性的抗原表位,然而不同隊伍對它們的排序有很大差別。研究者通過交叉兩個團隊的預測,并根據pMHC的平均排名重新排列組合這些預測結果(圖2B),更有可能產生整體改善的預測結果(圖2F)。這些結果提出了一種改進新生抗原預測的方法,即通過交叉和排名方法將兩個獨立預測結果結合。同時也表明了新生抗原表位的預測需要像TESLA這樣的聯盟協同行業(yè)共同發(fā)展。接著,研究人員對產生和未產生特異性抗原T細胞的多肽特征進行分析。研究人員首先在免疫原性和非免疫原性pMHC中評估了與抗原呈遞有關的“呈遞特征”,包括MHC結合親和力、結合時長與穩(wěn)定性,腫瘤表達豐度、肽疏水性和突變位置。研究結果顯示,與非免疫原性的pMHC相比,免疫原性pMHC具有更強的結合親和力(圖3C),腫瘤豐度明顯升高(圖3D),結合穩(wěn)定性顯著提高(圖3E),且疏水性顯著降低(圖3F)。結合強度與表達豐度不相關,同結合穩(wěn)定性負相關。而結合穩(wěn)定性則與疏水性正相關(圖3G H I)此外,具有免疫原性的多肽上常由9或10個氨基酸組成,其中的突變常發(fā)生在第三個氨基酸,而幾乎不發(fā)生在第二個氨基酸。(圖3J K L)基于上述特征,研究人員采用了隨機重復采樣的方式確定了它們的閾值,分別是結合強度小于34nM,腫瘤豐度大于33TPM和結合穩(wěn)定性大于1.4小時。通過閾值篩選可以過濾掉93%的非免疫原性肽,同時保持了55%的免疫原性肽(圖3L)。
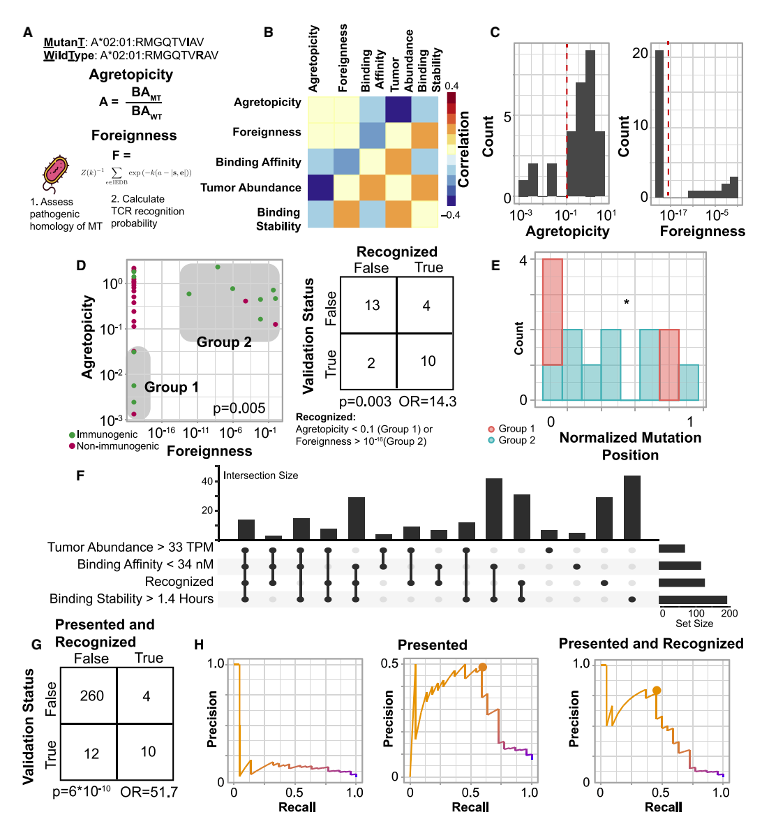
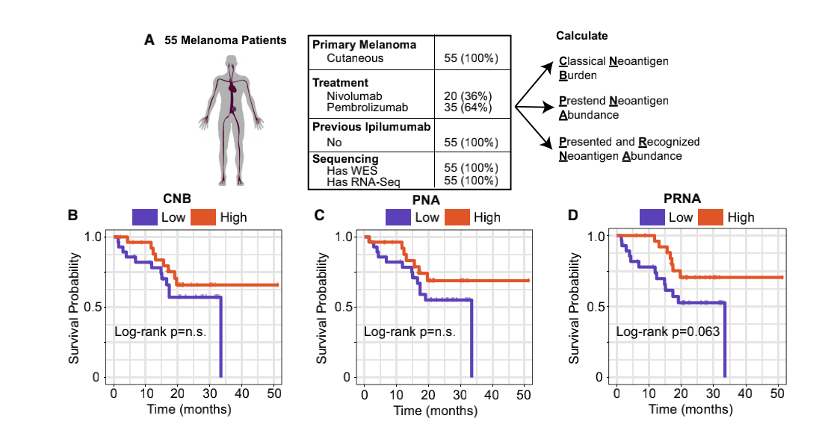
研究人員接著考量了兩個與多肽識別有關的特征:“聚合性”——突變多肽與正常多肽結合親和度的比值;“外來性”——同源病原性多肽的TCR識別概率。在29個pMHC中,研究顯示低聚合型或高外來性的多肽會被識別,這兩個特征僅在最有可能呈遞的肽中與免疫原性相關。通過整合呈遞特征與免疫原性肽識別特征,研究者共發(fā)現了四種預測多肽免疫原性的特征,分別是高結合親和度,高腫瘤豐度,高結合穩(wěn)定性和多肽識別度。同時運用這四種特征可以排除98%的無免疫原性多肽,并保留45%具有免疫原性的多肽。相應地,在預測中給這些特征施加更高權重的團隊通常能夠產生更精確的預測結果。腫瘤突變負荷是免疫檢查點抑制劑治療的生物標志物之一,但其在黑色素瘤中對免疫檢查點抑制劑治療療效的預測仍然有爭議[3]。那么,上述文中提到的與新生抗原預測有關的特征是否能夠在黑色素瘤中提高對免疫治療的預測效果?研究人員基于以上影響新生抗原預測的“抗原呈遞”和“多肽識別”相關特征開發(fā)了新生抗原負荷(PRNA),將PRNA對免疫治療療效預測效果與僅考慮MHC結合強度計算的新生抗原負荷CNB以及預測新生抗原豐度的PNA相比較,結果顯示,在55例接受免疫檢查點抑制劑治療的黑色素瘤患者中,PRNA能夠更好的預測接受ICB治療的黑色素瘤患者的生存時間(圖5)。最后,為了在其他獨立的隊列中驗證該預測模型相關特征。研究人員對3個黑色素瘤患者的WES和RNAseq數據進行分析,在310個pMHC中,有4個具有免疫原性(圖6A)。免疫原性多肽明顯具有更強的結合親和力(圖6B)、更高的腫瘤豐度(圖6C)和更長的結合穩(wěn)定性(圖6D)。對這些多肽使用相同的重復隨機采樣,確定了一個包含這三個特征的閾值集,該閾值集過濾了97%的非免疫原性肽,同時保留了75%的免疫原性肽(圖6E)。在其余10個符合所有“呈遞”標準的pMHC,同樣也100%符合“識別”標準(低聚合性和高外來性)(圖6F)。符合這種“呈遞”和“識別”特征的pMHC可以達到75%的召回率以及過濾掉99%的非免疫原性pMHC(圖6G)。這表明同時考慮抗原呈遞和識別的預測模型顯著提高了預測的精確率和召回率。
1.測試的多肽來源于小的體細胞變異,未考慮復雜的變異結構;
2.驗證中識別與T細胞特異性相關的肽,忽略了新生抗原的免疫原性可以通過適當的疫苗接種方法增強;
3.驗證中只關注MHC-I限制性抗原,沒有考慮到MHC-II限制性抗原和CD4+ T細胞的作用;
4.采用的方法關注于患者匹配樣本中腫瘤抗原的免疫原性,未解決同種異體背景下的規(guī)則。
但總體來看,這項研究依然提升了人們對于腫瘤新生抗原免疫原性預測的能力,并為未來的比較研究提供了基礎。
參考文獻:
[1] Sahin, Ugur. et al (2017). Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature, 547(7662), 222–226. doi:10.1038/nature23003[2] Wells, D. K. et al. (2020). Key Parameters of Tumor Epitope Immunogenicity Revealed Through a Consortium Approach Improve Neoantigen Prediction. Cell. doi:10.1016/j.cell.2020.09.015
[3] Luksza, M. et al. (2017). A neoantigen fifitness model predicts tumour response to checkpoint blockade immunotherapy. Nature 551, 517–520.
【 返回列表 】